------------------------------------------------------------------------------------
HISTORIA DEL ÁTOMO : modelos atómicos
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba
hecha la materia.
Unos 400 años antes de Cristo, el filósofo griego
Demócrito consideró
que la materia estaba constituida por pequeñísimas partículas que no
podían ser divididas en otras más pequeñas. Por ello, llamó a estas
partículas
átomos, que en griego quiere decir " indivisible ". Demócrito
atribuyó a los átomos las cualidades de ser eternos, inmutables e
indivisibles.
Sin embargo las ideas de Demócrito sobre la materia no fueron
aceptadas por los filósofos de su época y hubieron de transcurrir
cerca de 2200 años para que la idea de los átomos fuera tomada de
nuevo en consideración.
Los átomos son la unidad básica de toda la materia, la estructura que
define a todos los elementos y tiene propiedades químicas bien
definidas. Todos los elementos químicos de la tabla periódica están
compuestos por átomos con exactamente la misma estructura
y a su vez éstos, se componen de tres tipos de particulas;
MODELOS ATÓMICOS
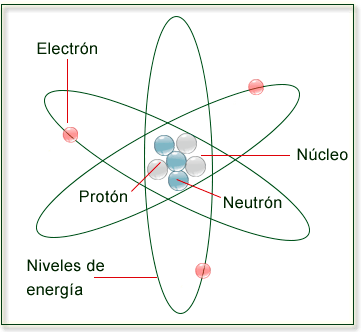
Estructura del átomo:
En el átomo distinguimos dos partes: el
núcleo y la
corteza.
- El núcleo: Es la parte central del átomo y contiene partículas con
carga positiva, los
protónes, y partículas que no poseen carga
eléctrica, es decir son neutras, los
neutrónes. La masa de un protón
es aproximadamente igual a la de un neutrón.
Todos los átomos de un elemento químico tiene en el núcleo el
mismo número de protones. Este número, que caracteriza a cada
elemento y lo distingue de los demás, es el
número atómico y se
representa con la letra (Z).
- La corteza: Es la parte exterior del átomo. En ella se encuentran
los
electrones, con carga negativa. Éstos, ordenados en distintos
niveles, giran alrededor del núcleo. La masa de un electrón es unas
2000 veces menor que la de un protón.
Los átomos son eléctrica-mente neutros, debido a que tienen igual
número de protones que de electrones. Así, el número atómico
también coinciden con el número de electrones.
Atomo + Sus electrones
ÁTOMO :
Un átomo consta de un núcleo que contiene neutrones y protones, así
como electrones que orbitan el núcleo. Esta partícula similar a un punto
es el objeto más pequeña que puede retener las propiedades de un
elemento. Y no puede ser separado o dividido por ningun metodo químico.
ELECTRON :
Un electrón está atado al núcleo del átomo y gira en órbita alrededor de él.
Esta parícula indivisible tiene una carga negativa, frecuentemende referida
como " menos 1 ". Su masa es 1/1,837 de la masa de un protón.
NEUTRON :
Lo calizados en el núcleo de los átomos, los neutrónes tienen una masa
ligeramente menor que los protones. Está partícula indivisible optiene su
nombre del hecho de que no tiene carga eléctrica. Es 1.839 veces el
tamaño en masa de un electrón.
PROTÓN :
Los elementos optienen su número atómico en base al número de
protónes que se encuentran en cada átomo. Es partícula indivisible en
el núcleo de un átomo tiene una carga positiva, referida como "1" en la
escala de peso atómico. Un protón tiene una masa 1.837 veces más
grande que la de un electrón.