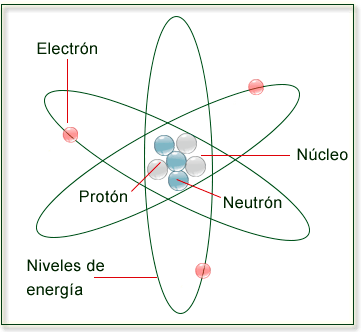
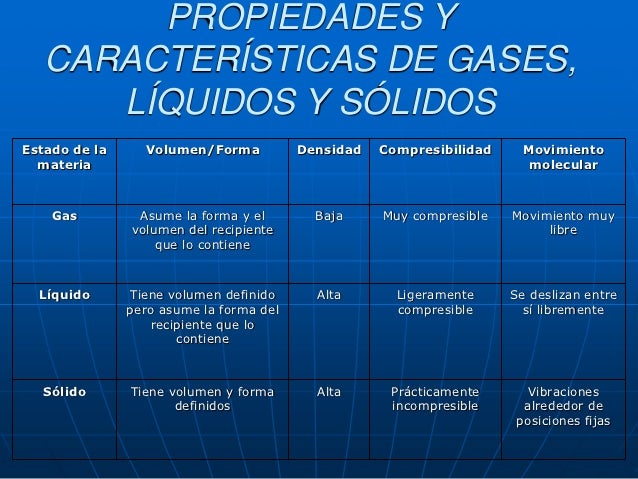
interacciones con aparatos de medida. En física y filosofía , materia
la misma forma por diversos sujetos. Se considera que es lo que forma
físicos. Es decir todo aquello que ocupa un sitio en el espacio, se puede
tocar, se puede sentir, se puede medir, etc.
diferenciar una sustancia de otra. Algunas de las propiedades generales
se les da el nombre de extensivas, pues su valor de pende de la cant-
tidad de materia, tal es caso de la
masa, peso, volumen, la inercia, la
energía, la impenetrabilidad, pososidad, divisibilidad, elasticidad,
maleabilidad, tenacidad y dureza entre otras.
⚫ LA MASA
Es una medida de la cantidad de
materia que posee un cuerpo.
Es una propiedad extrínseca de los cuerpos que determina la
medida de la
masa inercial y de la
masa gravitacional. La
unidad utilizada para medir la masa en el
Sistema
Internacional Unidades nidades es el
kilogramo (kg).
Es una
magnitud escalar.
Patrón de un kilogramo.
⬇

1 kilogramo (Kg) = 100 gramos (10³ g)
1 milidramo (mg) = un milésima gramo (10 menos ³ g)

Hablando con propiedad, hay que distinguir entre masa y peso.
Masa es una medida de la cantidad de peso de un objeto; peso es
una medida de la fuerza gravitatoria que actúa sobre el objeto.
⚫ EL VOLUMEN
Es una
magnitud métrica de tipo
escalar de finada como la
extensión en
tres dimensiones de una región del
espacio. Es una
magnitud derivada de la
longitud, ya que se halla multiplicado
la longitud, el ancho y la altura. Matemáticamente el volumen
es definible no sólo en cualquier espacio sino euclidiano, sino
también en otro tipo de espacios métricos que incluyen por
ejemplo a las
variedades de Remanir.
Desde un punto de vista
físico, los
cuerpos materiales ocupan
un volumen por el echo dehecho de ser extensos, fenómeno
que se debe al
principio exclusión de Pauli.
La
unidad de medida de volumen en el
Sistema
Internacional de Unidades es el
metro cúbico.
Para medir la capacidad, se utiliza el
litro. Por razones
históricas, existen unidades separadas para ambas, sin
embargo están relacionadas por la equivalencia entre el
litro y el
decímetro cúbico:
1 dm³ = 1 litro = 0,001 m³ = 1000 cm³ = 1 000 000 cm³ .
Para expresar el volumen sustancias
liquidas o
gaseosas, o incluso
para mercancías a
granel, se suele recurrir a la capacidad del
recipiente que lo contiene, medidas en
litros (l) y en
milímetros (ml)
y sus derivados. En
ocasiones, cuando la
densidad del material es constante y conocida,
se pueden expresar las cantidades por su equivalente en
peso lugar
de en volumen.
1 l = 1 dm³ 1 ml = 1 cm³
La unidad más utilizada para medir el volumen de
líquidos o
recipientes es el
litro (l) .
 Cuerpos geométricos o figuras
geométricas << sólidas >> que delimitan
volúmenes.
⚫ LA DENSIDAD
Cuerpos geométricos o figuras
geométricas << sólidas >> que delimitan
volúmenes.
⚫ LA DENSIDAD
Es una
magnitud escalar referida a la cantidad de
masa
en un determinado
volumen de una
sustancia.
La densidad se define como el cociente entre la masa de
un cuerpo y el volumen que ocupa.
Densidad = Masa/Volumen d m = m/V
La propiedad que nos permite medir la ligereza o pesadez de
una sustancia, recibe el nombre de densidad. Cuanto mayor
sea la densidad de un cuerpo, más pesado nos parecerá.
————
————————
Así, como en el Sistema Internacional, la masa se mide en kilogramos (kg)
y el volumen en metros cúbicos (m³) la densidad se medirá en
kilogramos por metro cúbico (kg/m³).
La mayoría de las sustancias tienen densidades similares a las del
agua por lo que, de usar esta unidad, se estarían usando números
muy grandes. Para evitarlo, se suele emplear otra unidad de
medida, el gramo por centímetro cúbico (gr/cm³).
La densidad de un cuerpo está relacionada con su flotabilidad,
una sustancia flotará sobre otra si su densidad es menor.
———————

Por eso la madera flota sobre el agua y el plomo se hunde en ella,
Por que el plomo posee mayor densidad que el agua mientras que
la densidad de la madera es menor, pero ambas sustancias se
hundirán en la gasolina, de densidad más vaja.
————————

La densidad del agua es 1 gr./cm³, esto quiere decir que 1 litro
de agua equivale igualmente a un 1 kilogramo de agua.
————————
Cada tipo de sustancia pura tiene un valor determinado de
densidad, característico de esa sustancia.
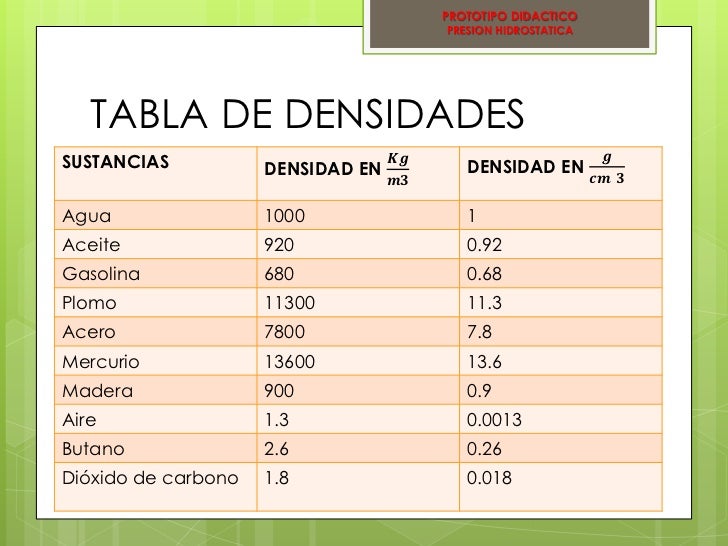
La densidad se puede calcular de forma directa midiendo,
independiente, la masa y el volumen de una muestra.
⚫LA TEMPERATURA
Es una
medida de la intensidad de calor. Aunque tenga una estrecha
relación, no debemos confundir la temperatura con el calor.
La temperatura es una propiedad física que se refiere a las nociones
nociones comunes de calor o ausencia de calor, sin embargo su significado
formal en termodinámica es más complejo. Termodinámica mente se
habla de la velocidad promedio a la energía cinética ( movimiento) de las
moléculas, siendo de esta manera, la temperatura alta, las velocidades de
las partículas son altas, en el cero absoluto (0 K) las partículas no tienen
movimiento. A menudo el calor o el frío percibida por las personas que
tiene más que ver con la
sensación térmica (ver más abajo),
que con la
temperatura real. Fundamentalmente, la temperatura es una propiedad
que poseen los sistemas físicos a nivel macroscópico, la cual tiene una
causa a nivel microscópico, que es la energía promedio por la partícula.
Y actualmente, al contrario de otras cantidades termodinámicas
como el calor o la entropía, cuya definiciones microscópicas son
validas muy lejos del equilibrio térmico, la temperatura solo pude ser
medida en el equilibrio, precisamente se define como un promedio.
La temperatura está íntimamente relacionada con la
energía interna
y con la
entalpía de un sistema: a mayor temperatura mayores serán
la eenergía interna y la entalpía del sistema.
––––––––
En el
Sistema Internacional de Unidades, la unidad de
temperatura es el grado
Kelvin (K).
Actualmente se utilizan tres escalas para medir la temperatura:
la escala
Celsius, es la que todos estamos acostumbrados a
usar, la
Fahrenheit se usa en los países anglosajones y la
escala
Kelvin de uso científico.
| Nombre | Símbolo | Temperatura de referencia | Equivalencia |
Escala
Celsius |
ºC
|
Puntos de congelación (0ºC) y ebullición del agua (100ºC)
|
---------------
|
Escala
Fahrenheit |
ºF
|
Punto de congelación de una mezcla aanticongelante de agua y sal y temperatura del cuerpo humano.
|
ºF = 1,8 ºC + 32
|
Escala Kelvin
|
K
|
Cero absoluto (temperatura más baja posible) y puntos de congelación (273 ºC) y ebullición (373 ºC) del
agua.
|
K = ºC + 273
|
El punto 0 de la escala Kelvin es el estado en que las partículas no tienen agitación
térmica (0 absoluto, temperatura mínima), y a partir cada grado tiene el mismo tamaño
que en la escala Celsius. El hielo se funde a 273 K y el agua ebulle a 373 K.