Estados de la materia
La materia se presenta en tres estados o formas de agregación:
sólido, líquido y gaseoso.
sólido, líquido y gaseoso.

Dadas las condiciones existentes en la superficie terrestre, sólo algunas
sustancias pueden hallarse de modo natural en los tres estados,
tal es el caso del agua. La mayoría de sustancias se presentan
sustancias pueden hallarse de modo natural en los tres estados,
tal es el caso del agua. La mayoría de sustancias se presentan
en un estados concreto. Así, los metales o las sustancias
que constituyen los minerales se encuentran en estado
sólido y el oxígeno o el CO² en estado gaseoso:
que constituyen los minerales se encuentran en estado
sólido y el oxígeno o el CO² en estado gaseoso:
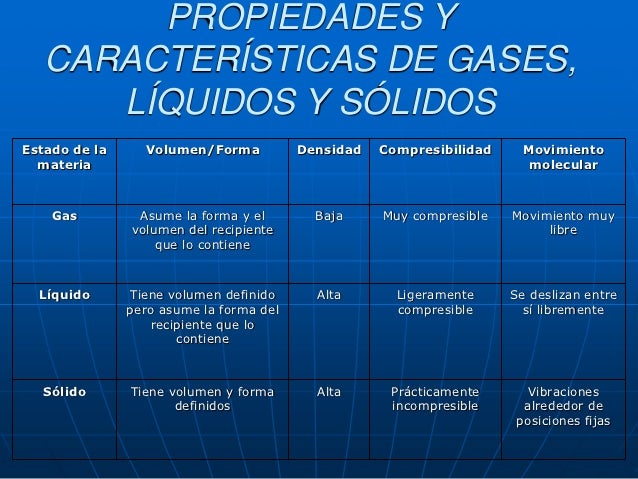
Los sólidos: Tienen forma y volumen constante.
Se caracterizan por la rigidez y regularidad de sus estructuras.
Los líquidos: No tienen forma fija pero sí volumen.
La variabilidad de forma y el presentar unas propiedades muy
específicas son características de los líquidos.
Los gases: No tienen forma ni volumen fijos. En
ellos es muy característica la gran variación de volumen que
experimentan al cambiar las condiciones de temperatura y presión.
Los sólidos se caracterizan por tener forma y volumen constantes. Esto se debe
a que las partículas que los forman están unidas por unas fuerzas de atracción grandes
de modo que ocupan posiciones casi fijas.
En el estado sólido las partículas solamente pueden moverse vibrando u oscilando
al rededor de posiciones fijas, pero no pueden moverse trasladándose libremente a lo largo del sólido.
Las partículas en el estado sólido propiamente dicho, se disponen de forma ordenada, con una regularidad especial geométrica, que da lugar a diversas estructuras cristalinas. Al aumentar la temperatura aumenta la vibración de las partículas:
Los líquidos, al igual que los sólidos, tienen volumen constante. En los líquidos
las partículas están unidas por unas fuerzas de atracción menores que en los sólidos, por esta razón las partículas de un líquido pueden trasladarse con
libertad. El número de partículas por unidad de volumen es muy alto, por
ello son muy frecuentes las colisiones y fricciones entre ellas.
Así se explica que los líquidos no tengan forma fija y adopten la forma del
recipiente que los contiene. También se explican propiedades como la fluidez
o la viscosidad. En los líquidos el movimiento es desordenado, pero existen asociaciones de varias partículas que, como si fueran una, se mueven al unísono.
Al aumentar la temperatura aumenta la movilidad de las partículas (su energía).
Los gases, igual que los líquidos, no tienen forma fija pero, a diferencia de
éstos, su volumen tampoco es fijo. También son fluidos, como los líquidos.
En los gases, las fuerzas que mantienen unidas las partículas son muy
pequeñas. En un gas el número de partículas por unidad de volumen es también
muy pequeño. Las partículas se mueven de forma desordenada, con choques
entre ellas y con las paredes del recipiente que los contiene. Esto explica las
propiedades de expansibilidad y compresibilidad que presentan los gases:
sus partículas se mueven libremente, de modo que ocupan todo el espacio
disponible. La compresibilidad tiene un límite, si se reduce mucho el volumen
en que se encuentra confinado un gas éste pasará a estado líquido. Al aumentar
la temperatura las partículas se mueven más deprisa y chocan con más energía
contra las paredes del recipiente, por lo que aumenta la presión:

Cuando un cuerpo, por acción del calor o del frió pasa de un estado a otro,
decimos que ha cambiado de estado. En el caso del agua: cuando hace calor,
el hielo se derrite y si calentamos agua líquida vemos que se evapora. El resto
de las sustancias también puede cambiar de estado si se modifican las
condiciones en que se encuentran. Además de la temperatura, también la
presión influye en el estado en que se encuentran las sustancias.
Si se calienta un sólido, llega un momento en que se transforma en líquido. Este
proceso recibe el nombre de fusión. El punto de fusión es la temperatura que
debe alcanzar una sustancia sólida para fundirse. Cada sustancia posee un punto
de fusión característico. Por ejemplo, el punto de fusión del agua pura
es 0 ºC a la presión atmosférica normal.
Si calentamos un líquido, se transforma en gas. Este proceso recibe el nombre de
vaporización. Cuando la vaporización tiene lugar en toda la masa de líquido,
formándose burbujas de vapor en su interior, se denomina ebullición. También
la temperatura de ebullición es característica de cada sustancia y se denomina
punto de ebullición. El punto de ebullición del agua es 100 ºC
a la presión atmosférica normal.
Simulación: (pulsa el botón para encender el mechero y observa los cambios)

En el estado sólido las partículas están órdenadas y se mueven oscilando
al rededor de sus posiciones. A medida que calentamos el agua, las partículas
ganan energía y se mueven más deprisa, pero conservan sus posiciones.
Cuando la temperatura alcanza el punto de fusión (0ºC) la velocidad
de las partículas es lo suficientemente alta para que algunas de ellas puedan
vencer las fuerzas de atracción del estado sólido y abandonan las posiciones
que ocupan. La estructura cristalina se va desmoronando poco a poco.
Durante todo el proceso de fusión del hielo la temperatura se mantiene constante.
En el estado líquido, las partículas están muy próximas, moviéndose con libertad y deforma desordenada. A medida que calentamos el líquido, las
partículas se mueven más rápido y la temperatura aumenta. En la superficie
del líquido se da el proceso de vaporización, algunas partículas tienen la
suficiente energía para escapar. Si la temperatura aumenta, el número de
partículas que se escapan es mayor, es decir, el líquido se evapora más
rápidamente.
Cuando la temperatura del líquido alcanza el punto de ebullición,
la velocidad con que se mueven las partículas es tan alta que el proceso de
vaporización, además de darse en la superficie, se produce en cualquier punto
del interior, formándose las típicas burbujas de vapor de agua, que suben a la superficie. En este punto la energía comunicada por la llama se invierte en
lanzar a las partículas al estado gaseoso, y la temperatura del líquido no
cambia (100ºC).
En el estado de vapor, las partículas de agua se mueven libremente, ocupando
mucho más espacio que en estado líquido. Si calentamos el vapor de agua, la
energía la absorben las partículas y ganan velocidad, por lo tanto la
temperatura sube.
Estados: actividades finales
1.- Completa el texto siguiente:
Al calentar un sólido se transforma en líquido; este cambio de estado se
denomina ---------------- .
El punto de fusión es la ---------------- a la que ocurre dicho proceso.
Al subir la temperatura de un líquido se alcanza un punto en el que se forman
burbujas de vapor en su interior, es el punto de -------- ; en ese punto la temperatura del
líquido permanece.
líquido permanece.
2.- Clasifica las siguientes características según se correspondan a los
sólidos, a los líquidos o a los gases:





